工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:
下列说法正确的是
| A.酸溶时,MnO2作还原剂 | B.可用盐酸代替硫酸进行酸溶 |
| C.原料硫酸可以循环使用 | D.在电解池的阴极处产生MnO2 |
某工厂用Ca SO4、NH3、HO、CO制备(NH4)2SO4,其工艺流程如下: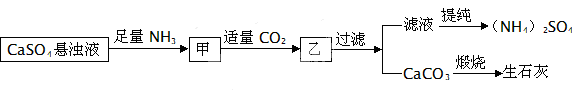
下列推断不合理的是
| A.先通二氧化碳,再通氨气,效果相同 | B.生成1mol(NH4)2SO4至少消耗2molNH3 |
| C.CO可被循环使用 | D.向甲中通二氧化碳有利于制备(NH4)2SO4 |
工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下: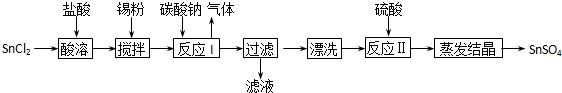
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol•L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
(12分)【化学——化学与技术】
资源开发、材料制备及工农业生产等都离不开化学。请回答下列问题:
(1)工业制肥皂时,在皂化反应结束后需要在混合物中加入饱和食盐水。加入饱和食盐水的目的是 。
(2)Al2O3的熔点高达2050oC,工业上为了降低能量消耗,在金属铝的冶炼中通常采取的措施是 。
(3)工业上合成氨所需的氮气来源于 ,氢气来源于 ,写出工业上在催化剂作用下制取氢气的其中一个化学方程式 。
(4)工业制硫酸时,SO3的生成是在 (填设备名称)中进行的,工业上常采用浓硫酸吸收SO3,而不直接用水吸收的原因是 。在吸收塔中,为提高SO3的吸收率所采取的措施为 。
下列物质属于复合材料的是
| A.普通玻璃 | B.普通钢 | C.玻璃钢 | D.镁铝合金 |
化学与社会、生产、生活紧密相关,下列说法正确的是( )
①石英只可用于生产光导纤维,且常温下不与任何酸反应;
②次氯酸钠溶液可用于环境的消毒杀菌;
③黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成;
④用铜片在加热的条件下就可鉴别浓硫酸和稀硫酸;
⑤在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
⑥某些抗酸药的主要成分是碳酸钠,作用是中和胃里过多的盐酸
| A.①②④⑤ | B.①②③④ | C.②④⑥ | D.② ③④ |
下列制品与材料类别不对应的是
| A |
B |
C |
D |
||
 玻璃 |

|
 不锈钢 |
 玻璃钢 |
||
| 无机非金属材料 |
有机高分子材料 |
金属材料 |
复合材料 |
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式 ;
②写出“联合制碱法”有关反应的化学方程式________________。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同______________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
① 炼钢时,加入硅、锰和铝的目的是_______________________。
② 不锈钢含有的Cr元素是在炼钢过程的氧吹____(填“前”或“后”)加入。
③ 炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
铬铁矿的主要成分的化学式为FeO·Cr2O3,还含有SiO2、Al2O3等杂质。工业上常采用固体碱熔氧化法用铬铁矿粉制备重铬酸钾,流程为:
已知:①NaFeO2遇水强烈水解;
②重铬酸钾为橙红色针状晶体,溶于水,不溶于乙醇,有强氧化性;
③2CrO42- + 2H+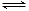 Cr2O72-+ H2O
Cr2O72-+ H2O
(1)灼烧操作一般在坩埚中进行,下列物质适合用来制作此实验坩埚材料的是
| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
(2)①铬铁矿经粉碎处理的目的是 。
②写出Cr2O3和纯碱、氧气反应生成Na2CrO4的化学方程式为 ;
③NaFeO2水浸时强烈水解生成氢氧化铁沉淀,离子方程式为___ ___。
(3)滤液1的成分除Na2CrO4、NaOH外,还含有(填化学式) ,
(4)通过途径Ⅰ从Na2CrO4溶液获得K2Cr2O7晶体,操作步骤有:“酸化”→加KCl固体→蒸发浓缩→操作a→过滤→洗涤→干燥。
① “酸化”步骤用醋酸调节溶液pH<5,其目的是 ;
②操作a的名称 。
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下: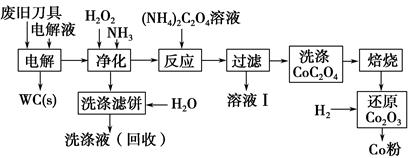
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为 。
(2)净化步骤所得滤饼的主要成分是 。回收的洗涤液代替水配制电解液,目的是回收利用其中的 。
(3)溶液Ⅰ的主要成分是 。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 。
(4)将Co2O3还原成Co粉的化学反应方程式为 。
干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
| 物质 |
干燥效率 |
物质 |
干燥效率 |
| MgO |
0.008 |
ZnCl2 |
0.8 |
| CaO |
0.2 |
ZnBr2 |
1.1 |
分析以上数据,下列有关叙述错误的是
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
精细化学品具有品种多、批量少、产值高的特点。
(1)表面活性剂在工农业生产和日常生活中广泛应用,其优点是______________,能显著降低水与空气或其他物质的________,提高工业生产________,提高产品的________,故表面活性剂被称为_________________。
(2)在泡沫灭火器中添加表面活性剂可以提高灭火效果的原因是什么?
(3)精细化学品具有特定的功能,特殊的用途,如有些洗衣粉适用于洗衣机,加酶洗衣粉不能用于洗涤____________,医药和农药都有严格的________、__________等。
Ⅰ.工业上用铝土矿制取铝的流程如下: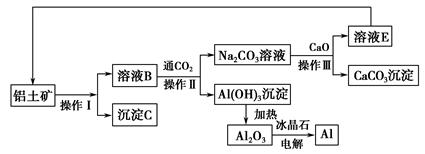
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有__________________________。
(2)写出由溶液B生成Al(OH)3的离子方程式:____________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为:_________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
Ⅱ.我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进。请回答下列问题:
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是________,目的是除去铁矿石中的脉石,其产物密度比铁________,所以在铁水的________(填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是________。
A.作为燃料,为炼铁中的化学反应提供能量
B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳
C.对高炉中的物料起到支撑和疏散的作用
D.作为溶剂,除去铁矿石中的杂质
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有________。
A.臭氧空洞 B.酸雨 C.一氧化碳毒害 D.沙尘暴
(4)写出高炉炼铁中与碳元素有关的氧化还原反应化学方程式:____________________________。
(5)从“三废”利用、环境保护等角度考虑,钢铁企业在生产中应采取的一些措施有(举出2种措施即可) _______________________________________。
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在________部分发生反应,在________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为____________________;加入硅、锰和铝的目的是________________________。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹________(填“前”或“后”)加入,原因是______________________。
(4)炼铁和炼钢生产中,尾气中均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作________。