下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_________________________。
甲与B反应的离子方程式 ___________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是___________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式: ____________________。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明_____________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:

(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_____ ____。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。

(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式______________________________。
(3)反应②的离子方程式_______________________________。
(4)F→G的化学方程式_________________________________。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互的转化关系如下图所示。请回答下列问题: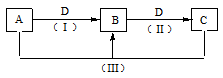
(1)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一.
①A中所含化学键类型为___________,D的电子式为___________;
②25℃时,0.1mol•L-1 B、C溶液,pH较大的是___________溶液(填溶质的化学式),写出B溶液中显电中性的原因___________,已知,B溶液里的pH=10,则其水电离出来的H+的浓度为________________。
(2)向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol
II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol
III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol
Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol
请回答下列问题:
①CH4的燃烧热△H________△H1.(填“>”、“<”或“=”);
②在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII________EIII(填“>”、“<”或“=”)。
置换反应的通式可用右图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:

(1)若单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,则甲是 。
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的离子反应方程式为 。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(4)若气体单质乙能在空气中燃烧,化合物B为黑色磁性晶体,写出该反应的化学方程式 。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应,回答下列问题:
(1)M中存在的化学键类型为_______________________;
(2)一定条件下,Z与H2反应转化为ZH4,ZH4的电子式为_______________;
(3)已知A与1molAl反应转化为X时(所有物质均为固体)的热效应为akJ,则该反应的热化学方程式为_______________;
(4)A与过量D的稀溶液反应生成G的离子方程式为_______________;
(5)向含4molD的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系图乙中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。

(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)除去D溶液中混有的少量G的方法是: 。
已知A为一种盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、
H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
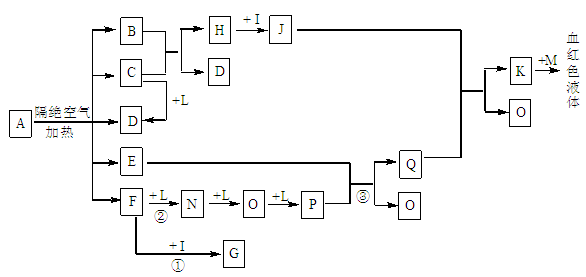
(1)写出D的电子式为_______________;
(2)写出反应②的化学方程式: ;反应③中氧化剂和还原剂的物质的量之比为_________________;
(3)将等体积、等浓度的G和F的溶液混合,溶液显碱性,则溶液中离子浓度从大到小的顺序为 ;
(4)检验J中阳离子的实验方法为 ;
(5)已知B中氧元素的质量分数为22.2﹪,且A分解产生的各物质的物质的量之比为n(B):n(C):
n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为__________________________。
已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
| A.钝化铁片 | B.检验Ba2+ | C.干燥氨气 | D.干燥氯气 |
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
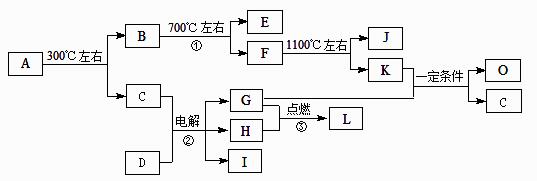
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
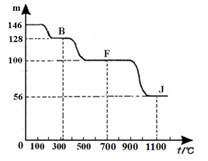
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体.L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)含碳量在0.03%~2%之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)K与氨水反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:

(1) 写出反应②的化学反应方程式 ,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是 。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间。则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水。则A过量时反应①的离子反应方程式是 。
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)

(1)写出下列物质的化学式:E J
(2)写出D通入足量稀Ba(NO3)2溶液反应的化学方程式:_______________________
(3)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在Al制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,写出该反应的离子方程式_____________
(4)A电池性能优越,A-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2A+3AgO+2NaOH=2NaAO2+3Ag+H2O,下列说法正确的是

A.该隔膜是阳离子交换膜
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.01 mol
C.A电极的反应式为:A-3e-+4OH-=AO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-
A~G为中学常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A是绿色固体,含H、C、O、Cu四种元素。常温下D为无色无味气体,B为黑色粉末,E能发生银镜反应。
请回答:
(1)D跟G反应的化学方程式为________________________;
(2)F中一定含有的官能团的名称为_______________________;
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,探究A中各元素的质量关系。
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
②向装置中鼓入空气的目的是_________;丙装置中药品的名称为___________,实验时,该药品未见明显变化,证明______________;
③如何判断A已完全分解?
____________________________________________
____________________________________________。
④更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):____________________。
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
| A.X、Y、Z一定都是非金属单质 |
| B.X、Y、Z一定都是金属单质 |
| C.X、Y、Z中至少有一种是非金属单质 |
| D.X、Y、Z中至少有一种是金属单质 |
下图中A~J均为中学化学中常见的物质.它们之间有如下转化关系。其中,A、D为金属单质,A元素是地壳中含量最多的金属元素(反应过程中生成的水及其它产物己略去)
请回答以下问题:
(1)B是______,H是________(填化学式)。
(2)写出A直接转化为F的离子反应方程式:_____________。
(3)写出E与过量氨水反应的离子反应方程式:_______________。
(4)H在空气中转化为I 的化学反应方程式:__________________。
(5)写出A与B高温下发生的化学反应方程式__________________。
(6)用一个离子方程式表示E转化为F___________________。