已知元素周期表中第三周期各元素原子结构示意图如下,请回答:
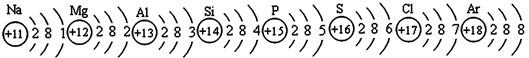
(1)在化学反应中,钠元素的原子容易失去电子变成 (填“阴”或“阳”)离子;
(2)元素的化学性质与原子结构中的 数关系密切;
(3)从原子结构方面看:同一周期的元素具有相同的 数;
(4)在此周期中,各元素的原子结构呈现的变化规律是: 依次递增。
已知元素周期表中第三周期各元素原子结构示意图如下,请回答:
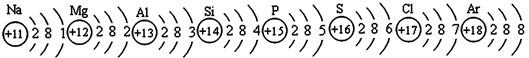
(1)在化学反应中,钠元素的原子容易失去电子变成 (填“阴”或“阳”)离子;
(2)元素的化学性质与原子结构中的 数关系密切;
(3)从原子结构方面看:同一周期的元素具有相同的 数;
(4)在此周期中,各元素的原子结构呈现的变化规律是: 依次递增。