已知下列热化学方程式:
① △H=-285.8kJ/mol
△H=-285.8kJ/mol
②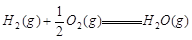 △H=-241.8kJ/mol
△H=-241.8kJ/mol
③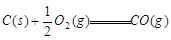 △H=-110.5kJ/mol
△H=-110.5kJ/mol
④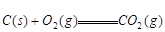 △H=-393.5kJ/mol
△H=-393.5kJ/mol
回答下列各问题:
(1)H2的燃烧热为_______________;C的燃烧热为_______________。
(2)燃烧10g H2生成液体水,放出的热量为__________________.
(3)CO的燃烧热的热化学方程式为________________________.
已知下列热化学方程式:
① △H=-285.8kJ/mol
△H=-285.8kJ/mol
②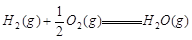 △H=-241.8kJ/mol
△H=-241.8kJ/mol
③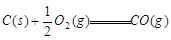 △H=-110.5kJ/mol
△H=-110.5kJ/mol
④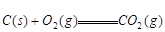 △H=-393.5kJ/mol
△H=-393.5kJ/mol
回答下列各问题:
(1)H2的燃烧热为_______________;C的燃烧热为_______________。
(2)燃烧10g H2生成液体水,放出的热量为__________________.
(3)CO的燃烧热的热化学方程式为________________________.