某课外兴趣小组用下图装置进行实验,试回答: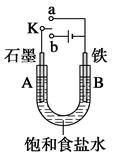
(1)若开始时开关K与a连接,则A电极反应式为_____________________。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 ,
则B电极反应式为______________________。开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为 。
某课外兴趣小组用下图装置进行实验,试回答:
(1)若开始时开关K与a连接,则A电极反应式为_____________________。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 ,
则B电极反应式为______________________。开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为 。