空气污染问题日益引起全民关注。工业生产中产生的SO2、NO等为主要污染物。根据你所学化学知识完成下列问题:
Ⅰ.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是_________(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
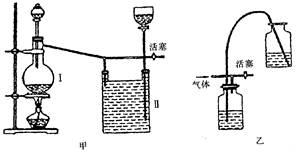
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的_______(填下列序号字母)。

(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条火准)。
下列有关说法正确的是___________

| A.蓝色石蕊试纸先变红后褪色 |
| B.湿润的品红试纸、蘸有KMnO4溶液的滤纸均褪色证明SO2具有漂白性 |
| C.湿润的淀粉KI-试纸未变蓝说明SO2的氧化性强于I2 |
| D.NaOH溶液可用于除去实验中多余的SO2 |
(4)一定温度下,在密闭容器中SO2与O2反应生成1molSO3气体时,放出akJ热量。
①该温度下SO2与O2反应的热化学方程式为__________________________。
②已知:2NO(g)+O2(g)═2NO2(g) △H=" -b" kJ•mol-1 (a>b>0)
则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=________________。
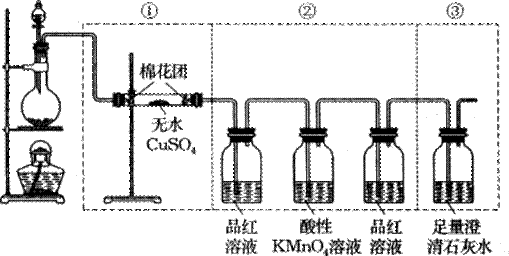
Ⅱ.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如下图流程图所示:

(1)步骤①中反应的离子方程式为____________________________。
(2)步骤②中Ba(OH)2是否足量的判断方法是____________________________。
Ⅲ.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-的离子方程式__________。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示;
图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为__________。
(3)已知进人装置Ⅳ的溶液中NO2-的浓度为 0.75mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为_______L。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号