下表是几种弱酸常温下的电离平衡常数:
| CH3COOH |
H2CO3 |
H2S |
H3PO4 |
| 1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
K1=9.1×10-8 K2=1.1×10-12 |
K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是 ,最弱的是 。
(2)多元弱酸的二级电离程度远小于一级电离的原因是 。
(3)同浓度的CH3COO-、HCO3—、CO32—、S2-结合H+的能力由强到弱的顺序为 。
(4)在温度相同时,各弱酸的K值不同,K值越大酸越 (填“强”或 “弱”)。
(5)根据K值大小判断下列反应能否发生:CH3COOH + H2PO4- (填“能”或“不能”,下同) H2CO3 + HS-
(填“能”或“不能”,下同) H2CO3 + HS- 。
。

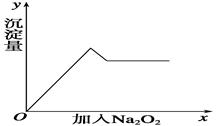
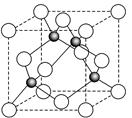
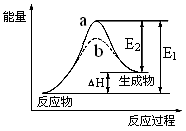
 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
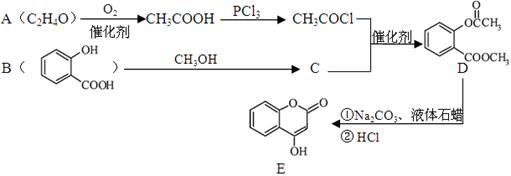

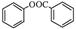 )是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
)是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号