电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO- 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1 FeSO4溶液V1 mL(过量),以如图所示装置煮沸。

步骤6:冷却,用c mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2 mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④ 该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。
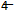 +H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。 2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:


 粤公网安备 44130202000953号
粤公网安备 44130202000953号