电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是 。
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN) = C(OH-) D.C(HCN)+ C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________________________________ 。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;质子守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO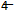 +H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
 CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0 
 粤公网安备 44130202000953号
粤公网安备 44130202000953号