已知: MnO2 +4HCl(浓)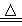 MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100ml过量的浓盐酸中,当反应生成3.36L Cl2气体时(标况),剩余溶液中盐酸的浓度为4mol/L(假设反应前后体积不变)。请回答下列问题:
MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100ml过量的浓盐酸中,当反应生成3.36L Cl2气体时(标况),剩余溶液中盐酸的浓度为4mol/L(假设反应前后体积不变)。请回答下列问题:
(1)该反应的氧化剂为 ;氧化产物为 (化学式填写)。
(2)反应耗用MnO2的质量为 ;
(3)被氧化的HCl物质的量为 ;
(4)原浓盐酸的物质的量浓度为 。
 (1)1个X分子中,可能含有 个氧原子,X不可以发生的反应有 (填序号)
(1)1个X分子中,可能含有 个氧原子,X不可以发生的反应有 (填序号)



 粤公网安备 44130202000953号
粤公网安备 44130202000953号