下图装置是实验室中物质分离的常用装置,请回答下列问题。

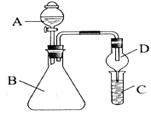
(1)A 图所示的操作名称是 ,仪器②的名称是 ,用此操作制取蒸馏水,还缺少的一种仪器是 ,①中加入少量碎瓷片的作用是 ,将仪器补充完整后进行试验若试验过程中发现忘加碎瓷片,应采取的正确操作是 ;
(2)用B 图所示装置将碘从水溶液中萃取出来,可用 作为萃取剂;混合、振荡、静止一段时间后,观察到的现象是 ;分液时水层应从分液漏斗的 口(填“上”或“下”)流出,实验过程中为保证液体顺利流下,应进行的具体操作是 。





 粤公网安备 44130202000953号
粤公网安备 44130202000953号