某二元醇A,含氧的质量分数为27.1%,其余是碳和氢。A有如下图转化关系,在转化的过程中碳原子的连接方式可能会发生变化,A、B、C、D分子结构中都有4个甲基 ,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)
,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)
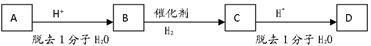
(1)A的相对分子质量是_________
(2)A和D的结构简式分别是________________和______

_________________
(3)B转化为C的化学方程式是(用有机物的结构简式表示):
__________________________________________________________________