(8分) 已知:25℃时,
H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
H2CO3 Ka1=4.4×10-7 Ka2=4.7×10-11
HNO2 Ka=5.1×10-4
HClO Ka=3.0×10-8
饱和NaClO溶液的浓度约为3 mol/L。
(1)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
(2)下列离子反应错误的是:_____________。
A.2HCO3-+SO2= SO32-+2CO2+ H2O
B.ClO-+CO2+ H2O=" HClO+" HCO3-
C.ClO-+SO2+ H2O=" HClO+" HSO3-
D.2ClO-+SO2+ H2O=" 2HClO+" SO32-
(3)某消毒液的有效成分为NaClO,还含有一定量的NaOH等,下列用来解释事实的方程式中不合理的是:_________。
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH-
HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用: H++ ClO-= HClO
(4)25℃时,0.1 mol下列气体分别与1 L0.l mol·L-1的NaOH溶液反应,形成的溶液pH由大到小的顺序为:__________(用A、B、C、D表示)。
A.NO2 B.SO2 C.SO3 D.CO2
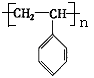 ,试回答下列问题:
,试回答下列问题: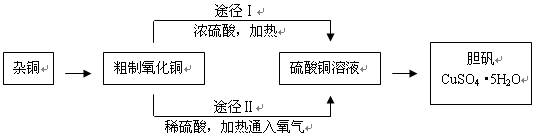
 粤公网安备 44130202000953号
粤公网安备 44130202000953号