I.氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
(1)反应开始时反应速率加快的原因是___________________。
(2)反应后期反应速率下降的原因是___________________。
II.用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。
(1)下列说法正确的是______(填序号)。
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产生 |
| B.a电极上发生的反应为2H++2e-===H2↑和4OH--4e-===2H2O+O2↑ |
| C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1 |
| D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化 |
(2)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的c(H+)= ______。(3)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为______mol。
(4)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
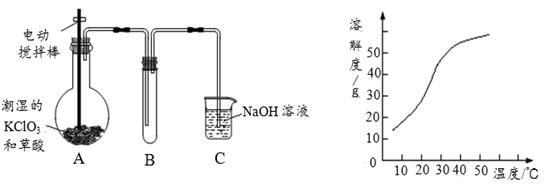
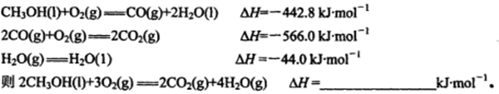
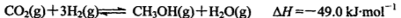
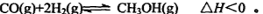
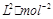 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
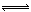 2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: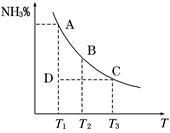
 粤公网安备 44130202000953号
粤公网安备 44130202000953号