甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下: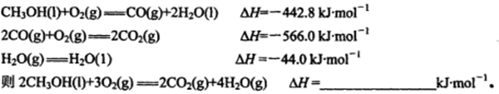
(2)工业上正在研究利用CO2和H2来生产甲醇燃料的方法,该反应为: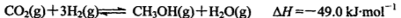
在某温度下,将6mol CO2和8mol H2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
①用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH) = .
②此温度下该反应平衡常数K=____________;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率_________75% (填“大于”、“小于”或“等于”)。
(3)一氧化碳与氢气也可以合成甲醇: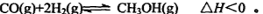
①若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的焓变不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数
K="50" 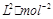 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
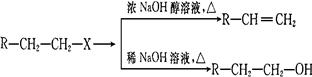
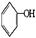 合成
合成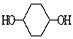 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
 D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号