常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1 moI/L HA溶液的pH,即可证明HA是弱电解质。
乙:①分别取pH=l的HA溶液和稀盐酸各10.00 mL,再加水稀释为100 mL:
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质。
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质。
| 编号 |
NaOH/mol·L-1 |
HA/mol·L-1 |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.2 |
pH<7 |
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH_______1(填“>”、“<”或“=”)。甲进行实验时的具体操作方法是_______________。
(2)在乙的方案的第①步中,需要用到的定量仪器是___________。pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是____________(填字母)。
a.HA溶液中水的电离程度大
b.稀盐酸中水的电离程度大
c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是_________(填字母)。
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c_______(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)________(填“>”、“<”或“=”)c(A-)。
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:________(填“强”、“弱”或“无法确定”)。

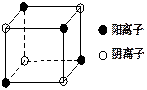
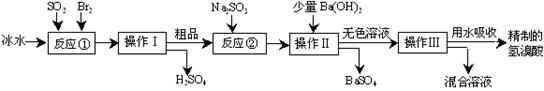 ⑴反应①中发生反应的化学方程式为 ;
⑴反应①中发生反应的化学方程式为 ; 粤公网安备 44130202000953号
粤公网安备 44130202000953号