Ⅰ.1100℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
(1)下列能判断反应达到平衡状态的是________。
| A.容器内气体压强不再变化 |
| B.H2的体积分数不再变化 |
| C.1 mol H-H键断裂同时2 mol H-O键形成 |
| D.Na2S的质量不再变化 |
E.υ(正)=υ(逆)
F.容器内气体密度不再变化
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为: 。
Ⅱ.丙烷燃料电池,以KOH溶液为电解质溶液。
(3)通入丙烷的电极为_____(填“正极”或“负极”),正极的电极反应式为 。
(4)燃料电池的优点________。
(5)若开始时电解质溶液中含KOH的物质的量为0.25 mol,当溶液中K2CO3的物质的量为0.1 mol时,消耗标准状况下丙烷的体积为 mL(保留一位小数)。

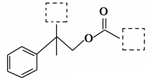
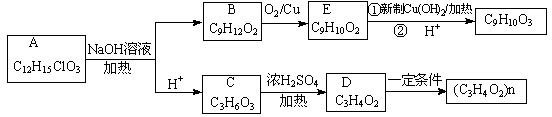
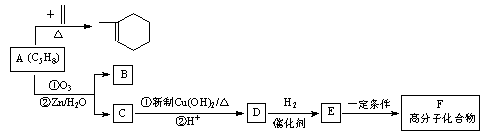
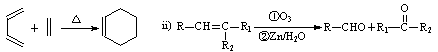
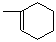 时,A发生的反应类型为 。
时,A发生的反应类型为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号