(8分)氨的合成是最重要的化工生产之一。
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)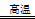 CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示: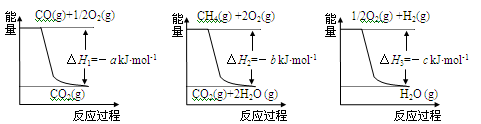
则△H4=______________(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
| 达到平衡的时间(min) |
t |
5 |
| 平衡时N2的浓度(mol·L-1) |
3 |
c |
①甲容器达到平衡所需要的时间t 5min(填“>”、“<” 或“=”,下同);乙容器达到平衡时N2的浓度c 3 mol·L-1。
②下图中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和 H2平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图。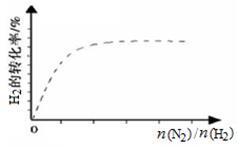
 2CO2 2H2+O2
2CO2 2H2+O2 CO2+2H2O
CO2+2H2O CO+H2,CO和H2的混合气体是合成多种有机物的原料气,研究由CO、H2合成有机物的化学称为一碳化学。下图是合成某些物质的路线图:
CO+H2,CO和H2的混合气体是合成多种有机物的原料气,研究由CO、H2合成有机物的化学称为一碳化学。下图是合成某些物质的路线图: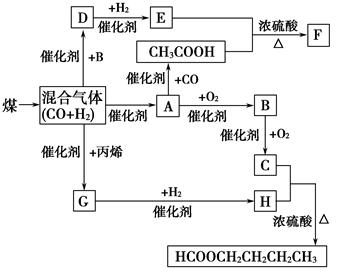
 CO(g)+H2(g)。
CO(g)+H2(g)。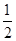 O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1 CO2(g)+H2O(g)
CO2(g)+H2O(g)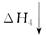
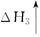
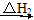 CO(g)+H2O(g)+
CO(g)+H2O(g)+ 粤公网安备 44130202000953号
粤公网安备 44130202000953号