新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题: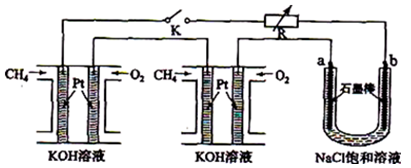
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a电极名称是 ,电极方程式为 。
(3)若标准状况下,每个燃料电池中通入1.12L甲烷气体完全反应,则电解池中产生氯气体积为 L。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a电极名称是 ,电极方程式为 。
(3)若标准状况下,每个燃料电池中通入1.12L甲烷气体完全反应,则电解池中产生氯气体积为 L。