二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,
该反应的化学方程式为:________________________ ________________。
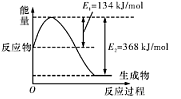
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+ CO(g) CH3OH(g); ΔH = -90.8 kJ·mol-1
CH3OH(g); ΔH = -90.8 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g); ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g); ΔH= -23.5 kJ·mol-1
③CO(g)+ H2O(g) CO2(g)+ H2(g); ΔH= -41.3 kJ·mol-1
CO2(g)+ H2(g); ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
若总反应平衡后,要提高CO的转化率,可以采取的措施是_ __(填字母代号)
a.升温
b.加催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下平衡常数为400 。
CH3OCH3(g)+ H2O(g)某温度下平衡常数为400 。
此温度下,某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol/L) |
0.85 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正___ ___ v逆 (填“>”、“<”或“=”)。
②若从此刻又经过10 min达到平衡, 则这段时间内反应速率v(CH3OH)= ___ ____ _ 。
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
 CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。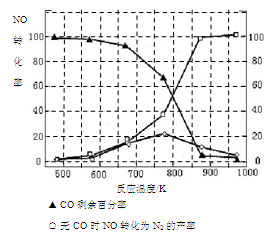
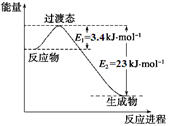
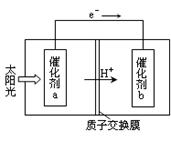
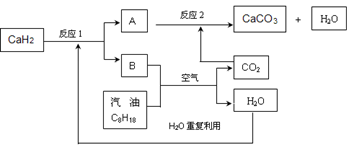


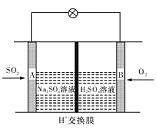
 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。 2NO(g) △H
2NO(g) △H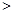 0
0 粤公网安备 44130202000953号
粤公网安备 44130202000953号