如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答: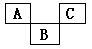
(1)写出元素符号:A ;
(2)C的离子结构示意图: ;B的最高价氧化物对应水化物的化学式为__________。
(3)A、B、C三种元素的气态氢化物中最稳定的是 (填氢化物化学式)
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
(1)写出元素符号:A ;
(2)C的离子结构示意图: ;B的最高价氧化物对应水化物的化学式为__________。
(3)A、B、C三种元素的气态氢化物中最稳定的是 (填氢化物化学式)