(6分)按下图装置实验,A、B两烧杯分别盛放200 g 10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。a、b、c为石墨电极,d为铜电极.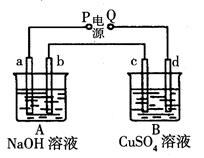
(1)标准状况下,b极产生气体的体积为__________L。
(2)c极上析出固体的质量为____________g。
(6分)按下图装置实验,A、B两烧杯分别盛放200 g 10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。a、b、c为石墨电极,d为铜电极.
(1)标准状况下,b极产生气体的体积为__________L。
(2)c极上析出固体的质量为____________g。