汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,汽车尾气的治理已经迫在眉睫。
(1)尾气中的CO主要来自于汽油的不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) ΔH= +221kJ·mol-1,简述该设想能否实现______(填“是”或“否”)依据是:_______________________________________。
②研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的ΔH______0(填“>”或“<”)若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L﹣1,在该条件下达到平衡时,CO的转化率为 。
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K。

①乙中产生的气体在标准状况下的体积为 。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0mol·L﹣1 NaOH溶液。
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________。

(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气。其反应方程式为:
CH4(g)+H2O(g) CO(g)+3H2(g) ΔH = +206.2kJ/mol [其中投料比n(CH4):n(H2O)=1:1]。对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数)。平衡时CH4的转化率与温度、压强(总压)的关系如图所示:
CO(g)+3H2(g) ΔH = +206.2kJ/mol [其中投料比n(CH4):n(H2O)=1:1]。对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数)。平衡时CH4的转化率与温度、压强(总压)的关系如图所示:

则p1__ p2 (填“>”或“<”),p2时M点的平衡常数KP=________(小数点后保留3位)。
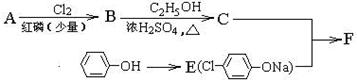
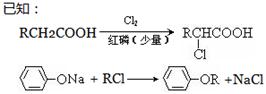 (注:R表示烃基或H原子)
(注:R表示烃基或H原子) 。
。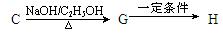
 。
。 可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为。
可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为。
 1)属于离子结构示意图的是 、 (填编号)。
1)属于离子结构示意图的是 、 (填编号)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号