甲醇(CH3OH)是一种优质燃料,(1)已知一定条件下每1MolCO2和足量氢气完全反应可生成1Mol气态甲醇(CH3OH)和1Mol 水蒸汽并放出49 kJ的热量。请回答:
①该反应的热化学方程式: 。
②其反应过程中能量的变化与如图所示最相符的是 。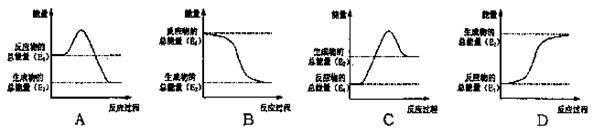
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1MolCO2和3MolH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图。
请回答: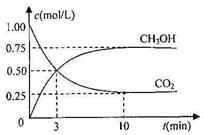
①从反应开始到平衡,甲醇和氢气的反应速率:
v(CH3OH)= 。
v(H2)= 。
②下列措施中能使v (CO2)增大的是 。
A.加入催化剂
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.升高温度
③能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3MolH2的同时生成1MolCH3OH

 所示,其中:
所示,其中: 过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号