(14分)锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ 锂的原子结构示意图为 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色。生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂。写出生成氮化锂的化学方程式 。锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物 _____(填化学式)。
Ⅱ 下面是从锂辉石(Li2O·Al2O3·SiO2)中提出锂的工业流程示意图。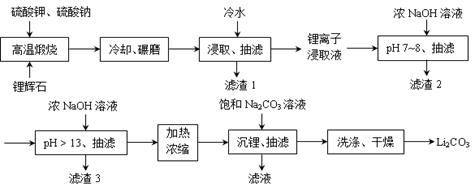
① 高温煅烧时的反应原理为:Li2O∙Al2O3∙SiO2+K2SO4= K2O∙Al2O3∙SiO2+Li2SO4;
Li2O∙Al2O3∙SiO2+Na2SO4= Na2O∙Al2O3∙SiO2+Li2SO4。
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
| 金属离子 |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
Mn(OH)2 |
| 沉淀完全的pH |
4.7 |
9.0 |
3.2 |
10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
| 温度 溶解度 |
10 |
20 |
50 |
80 |
| Li2SO4 |
35.4 |
34.7 |
33.1 |
31.7 |
| Li2CO3 |
1.43 |
1.33 |
1.08 |
0.85 |
(1)浸取时使用冷水的原因是 。
(2)滤渣2的主要成分为 。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH> 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是 ,用离子方程式表示其产生的原因 。
(4)加热浓缩的作用是 。
(5)洗涤Li2CO3晶体使用 。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。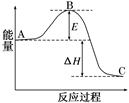
 2C(g)在密闭容器中达到平衡。
2C(g)在密闭容器中达到平衡。 2NH3(g) ΔH<0
2NH3(g) ΔH<0 粤公网安备 44130202000953号
粤公网安备 44130202000953号