某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
碳粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
|
36.0 |
| ③ |
|
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了 (填“氧化”或“还原”)反应,其电极反应式是 。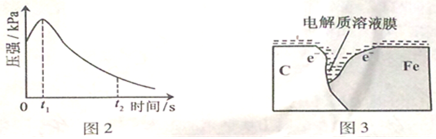
(3)经过相当长的一段时间,图1锥形瓶中混合物表面生成了一层红棕色的铁锈,取少量铁锈于试管中,加入稀盐酸,取少量反应之后的溶液检验其中的Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+。还可用KI来检验:2Fe3++2I- 2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
| 编号 |
实验操作 |
预期现象和结论 |
| ① |
在试管中加入少量该FeCl3溶液和 (填少量、过量)的KI溶液。 |
深红色如期出现 |
| ② |
将试管中的混合溶液转移至 (填仪器)中,倒入一定量的 , 塞住活塞,充分振荡(萃取),静置。 |
|
| ③ |
|
|



 CaCl2+2NH3↑+2H2O。问:
CaCl2+2NH3↑+2H2O。问:




 粤公网安备 44130202000953号
粤公网安备 44130202000953号