(10分) 聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用。有关转化关系如下: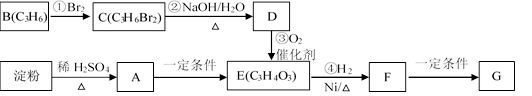
已知:CH3CH2CH2Br + NaOH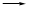 CH3CH2CH2OH + NaBr
CH3CH2CH2OH + NaBr
请回答下列问题:
(1)物质A的分子式为 ,B的结构简式为 ;
(2)请写出F中含氧官能团的名称 ;
(3)反应①~④中属于加成反应的是 ;
(4)写出由F生成聚合物G的化学方程式 。
(10分) 聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用。有关转化关系如下:
已知:CH3CH2CH2Br + NaOH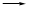 CH3CH2CH2OH + NaBr
CH3CH2CH2OH + NaBr
请回答下列问题:
(1)物质A的分子式为 ,B的结构简式为 ;
(2)请写出F中含氧官能团的名称 ;
(3)反应①~④中属于加成反应的是 ;
(4)写出由F生成聚合物G的化学方程式 。