(本题共12分)
23.铁与同周期的钙性质有很大的差异,铁的熔点更高,而钙的金属活动性更强,这都说明铁的金属键比钙更_____(选填“强”、“弱”)。与钢铁比,纯净的铁有很强的抗腐蚀性,原因____________________。氯化铁受热会发生升华现象这说明氯化铁是______________(选填“离子”、“共价”)化合物。
24.一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),该反应的平衡常数表达式K=__________。下列措施中能使平衡时c(CO)/c(CO2)增大的是___________(选填编号)。
FeO(s)+CO(g),该反应的平衡常数表达式K=__________。下列措施中能使平衡时c(CO)/c(CO2)增大的是___________(选填编号)。
a.升高温度 b.增大压强 c.充入一定量CO d.再加入一些铁粉
25.S2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-形式存在,请完成该反应的化学方程式。
______FeS2+______Fe2(SO4)3+___ _________→_____FeSO4+_____ __________
26.溶液的酸碱性对许多物质的氧化性有很大影响;生成物的溶解性会影响复分解反应的方向。将Na2S溶液滴加到FeCl3溶液中,有单质硫生成;将FeC13溶液滴加到Na2S溶液中生成的是Fe2S3而不是S或Fe(OH)3
从以上反应可得出的结论是______________________、_______________________________。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
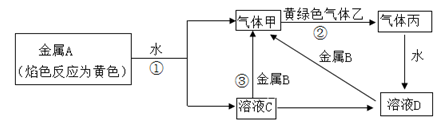
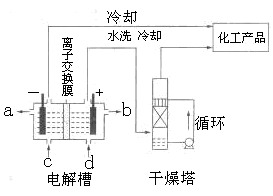
 4SiHCl3(g)
4SiHCl3(g)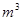 (标准状况)。
(标准状况)。