(16分)氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
⑴以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度。能包含这一过程的总反应方程式为
⑵现代氯碱工业多采用隔膜法进行电解,即用隔膜将电解槽分隔成阳极区和阴极区,则从阴极区排出的是,电解时用盐酸控制阳极区的PH在2~3,用化学平衡移动原理解释盐酸的作用:
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
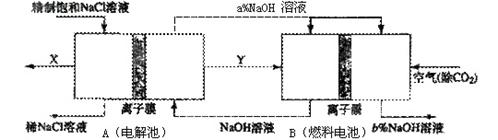 ①分析比较图中氢氧化鈉质量分数大小:a%(填“>”、“<”或“=”) b%,理由是
①分析比较图中氢氧化鈉质量分数大小:a%(填“>”、“<”或“=”) b%,理由是
②这样设计的主要节(电))能之处在于(至少写一处)
⑷科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱厂进行就近联合。请你判断该方案是否可行?(填可行或不可行),理由是