[化学一选修3:物质结构与性质](15分)A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为 ;D和E的电负性大小关系为 (用元素符号表示)。
(2)化合物E2D分子的空间构型为 ,中心原子采用 杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为 ,任意写出一种它的等电子体的化学式为 。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于 晶体,晶体内含有的作用力类型有 。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为 。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为 g/cm3。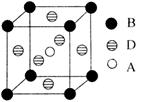
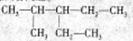 ,命名:_____________;
,命名:_____________;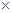 10-8cm,则E的密度为______________________.
10-8cm,则E的密度为______________________.



 键和
键和 键的个数之比为__________(填最简整数比);
键的个数之比为__________(填最简整数比);
 丙烯酸乙酯___________ ②苯
丙烯酸乙酯___________ ②苯 粤公网安备 44130202000953号
粤公网安备 44130202000953号