乙烯与乙烷的混合气体共a mol,与b mol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)=________。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前氧气的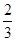 时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
(3)a的取值范围为________。
乙烯与乙烷的混合气体共a mol,与b mol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)=________。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前氧气的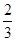 时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
(3)a的取值范围为________。