磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL
|
0.01mol·L-1
Na2SO3溶液的体积/mL
|
H2O的体积/mL
|
实验温度
/℃
|
溶液出现蓝色时所需时间/s
|
实验1
|
5
|
V1
|
35
|
25
|
|
实验2
|
5
|
5
|
40
|
25
|
|
实验3
|
5
|
5
|
V2
|
0
|
|
该实验的目的是______________________________________________;表中V2=___________mL
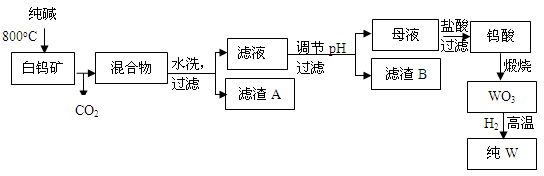
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是
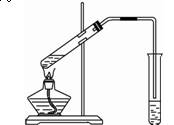


 器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。
器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。
 MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
 涤、烘干、称量.洗涤沉淀的操作是______________________________________
涤、烘干、称量.洗涤沉淀的操作是______________________________________ 分析法
分析法

 粤公网安备 44130202000953号
粤公网安备 44130202000953号