硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
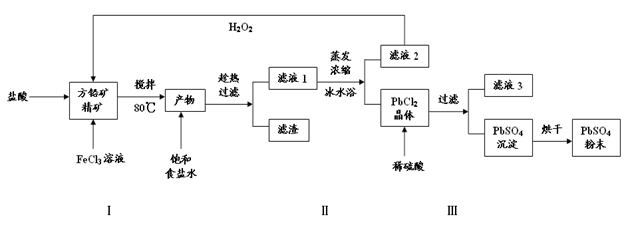
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42- (aq) △H>0
PbCl42- (aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为 ,步骤Ⅰ中另一个反应是H2O2与FeCl2、盐酸反应生成FeCl3,实现FeCl3的重复利用,其离子方程式为 ,加入盐酸的另一个目的是为了控制pH在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)滤液3是 。
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为 。

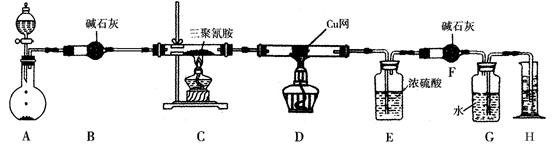

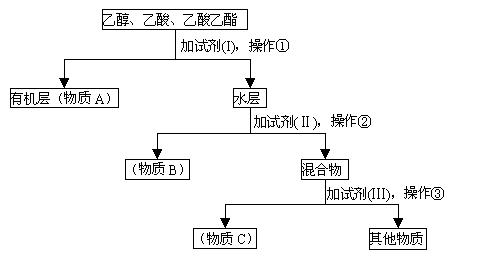
 (1)A、B、C是被回收的物质,它们分别是(写名称)
(1)A、B、C是被回收的物质,它们分别是(写名称) 粤公网安备 44130202000953号
粤公网安备 44130202000953号