工业合成氨的反应N2+3H2= 2NH3的能量变化如下图所示,请回答有关问题: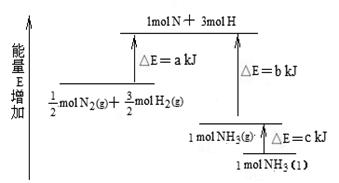
(1)合成 1 mol NH3(l) ____________(填“吸收”、“放出”)_____________kJ的热量。
(2)已知:拆开lmol H—H 键、lmol N-H 键、lmol N≡N 键分别需要的能量是436kJ、391kJ、946kJ。则上图中的 a=___________kJ;1 mol N2(g) 完全反应生成NH3(g)产生的能量变化为 ______KJ。
(3)推测反应 2NH3(l)= 2N2 (g)+3H2(g) 比反应2NH3(g)= 2N2 (g)+3H2(g)_____________(填“吸收”、“放出”)的热量____________(填“多”、“少”)。
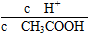 将________(填“增大”“减小”或“不变”);
将________(填“增大”“减小”或“不变”); H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液: Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0 粤公网安备 44130202000953号
粤公网安备 44130202000953号