钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如下: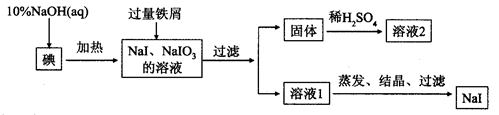
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中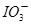 与IO-的物质的量之比为1 :1,则该反应的离子方程式为______________。
与IO-的物质的量之比为1 :1,则该反应的离子方程式为______________。
(2)生产流程中加入过量铁屑的目的是_____________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________________________。
(3)溶液2中除含有H+外,一定含有的阳离子是_____________;试设计实验证实该金属阳离子的存在__________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示: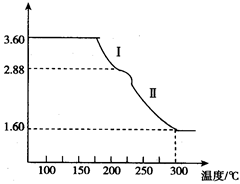
①分析图中数据,根据信息写出过程Ⅰ发生的化学方程式_______________________。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式__________________。

 KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )

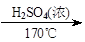 CH2=CH2+H2O
CH2=CH2+H2O
 粤公网安备 44130202000953号
粤公网安备 44130202000953号