水是生命之源,也是人类最宝贵的资源.
(1)下列各种水中,属于纯净物的是 (填字母);
| A.汽水 | B.矿泉水 |
| C.蒸馏水 | D.经过净化处理的自来水 |
(2)饮用硬度过大的水不利于人体健康,因此人们常采用 的方法将硬水软化;
(3)小刚为了净化收集到的雨水,自制了一个如图所示的简易净水器,其中小卵石、石英砂和彭松棉的作用是 .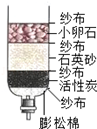
(4)自来水消毒过程发生的化学反应中有如下图所示的微观过程:
( 表示氯原子,
表示氯原子, 表示氧原子,
表示氧原子, 表示氢原子)
表示氢原子)
该反应中化合价发生变化的元素为 .
水是生命之源,也是人类最宝贵的资源.
(1)下列各种水中,属于纯净物的是 (填字母);
| A.汽水 | B.矿泉水 |
| C.蒸馏水 | D.经过净化处理的自来水 |
(2)饮用硬度过大的水不利于人体健康,因此人们常采用 的方法将硬水软化;
(3)小刚为了净化收集到的雨水,自制了一个如图所示的简易净水器,其中小卵石、石英砂和彭松棉的作用是 .
(4)自来水消毒过程发生的化学反应中有如下图所示的微观过程:
( 表示氯原子,
表示氯原子, 表示氧原子,
表示氧原子, 表示氢原子)
表示氢原子)
该反应中化合价发生变化的元素为 .