(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H=+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图。假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应II生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
a.c ( H2 )减少;
b.平衡常数K增大;
c.CH3OH 的物质的量增加;
d.正反应速率加快,逆反应速率减慢;
e.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,
则:
Co2+在阳极的电极反应式为: ;
除去甲醇的离子方程式为 。

 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想: 小外,还有_ _______。
小外,还有_ _______。 N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表: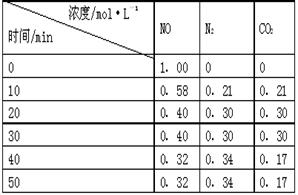
 粤公网安备 44130202000953号
粤公网安备 44130202000953号