1丁炔的最简式是________,它与过量溴加成后产物的结构简式是________;有机物A的分子式与1丁炔相同,而且属于同一类别,A与过量溴加成后产物的结构简式是________;与1丁炔属于同系物且所含碳原子数最少的有机物的名称是________,它能发生________(填反应类型)反应制造导电塑料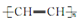 ,这是21世纪具有广阔前景的合成材料。
,这是21世纪具有广阔前景的合成材料。
1丁炔的最简式是________,它与过量溴加成后产物的结构简式是________;有机物A的分子式与1丁炔相同,而且属于同一类别,A与过量溴加成后产物的结构简式是________;与1丁炔属于同系物且所含碳原子数最少的有机物的名称是________,它能发生________(填反应类型)反应制造导电塑料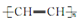 ,这是21世纪具有广阔前景的合成材料。
,这是21世纪具有广阔前景的合成材料。