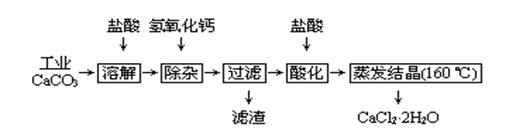
硫酸亚铁是一种重要的工业原料,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O)晶体,工艺流程如下所示:

(1)将过程③中的产生的气体通入下列溶液中,溶液不会褪色的是__________;
| A.品红溶液 | B.红色的酚酞试液 |
| C.酸性KMnO4溶液 | D.紫色石蕊溶液 |
(2)Z是_____,此时溶液X中发生反应的离子方程式为_____________________________。
(3)检验溶液Y中含有金属阳离子的实验方法是______________________。
(4)操作Ⅲ、Ⅳ等实验操作步骤为蒸发、冷却结晶、 (填操作名称)、洗涤。
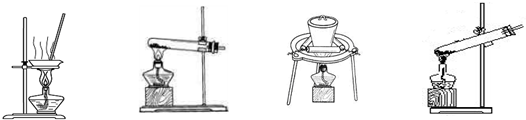
如下图所示,蒸发操作中的一处错误是 。

(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0产品,溶解,在250mL容量瓶中定容;
b.量取25mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①计算上述产品中FeSO4•7H2O的质量分数为________;
②若用上述方法测定的产品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有___________(只回答一条即可)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号