(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 |
Mg2(OH) 2C03 |
CaC03 |
BaS04 |
BaC03 |
| 2.6x 1 0-2 |
2.5×10-4 |
7.8x 10-4 |
2.4x 10-4 |
1.7 x 1 0-3 |
①检测Fe3+是否除尽的方法是__________________________________________________________。
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因______________________________。
③除去Mg2+的离子方程式是____________________________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测__________________________(填离子符号)。
(2)第二次精制要除去微量的Iˉ、IO3ˉ、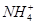 、Ca2+、Mg2+,流程示意如下:
、Ca2+、Mg2+,流程示意如下: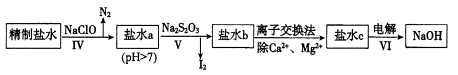
①过程IV除去的离子是____________________________________。
②盐水b中含有SO42-。Na2S203将IO3ˉ还原为I2的离子方程式是 ______________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______________________.
 粤公网安备 44130202000953号
粤公网安备 44130202000953号