下表为元素周期表中第三周期元素的原子结构示意图。请回答下列问题: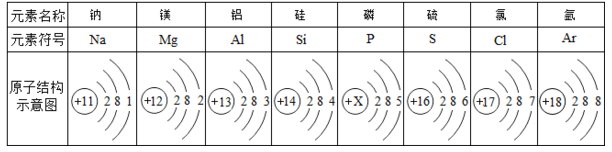
(1)表中磷原子的原子序数=___________
(2)表中具有相对稳定结构的元素是 (填元素名称)。
(3)在化学反应中,每个铝原子失去________个电子形成铝离子。
(4)原子结构与元素周期的规律之一:
下表为元素周期表中第三周期元素的原子结构示意图。请回答下列问题:
(1)表中磷原子的原子序数=___________
(2)表中具有相对稳定结构的元素是 (填元素名称)。
(3)在化学反应中,每个铝原子失去________个电子形成铝离子。
(4)原子结构与元素周期的规律之一: