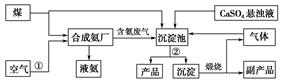
(12分) 向某密闭容器中加入0.3mol A、0.08mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示[t0~t1阶段的c(B)变化未画出]。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t4~t5阶段为增大容器体积(即减压)。
(1)写出该反应的化学方程式: 。
(2)若t1 = 30s,则t0~t1阶段以C浓度变化表示的反应速率为v(C) = ;t1~t2的平衡常数K = 。
(3)若t2~t3阶段,C的体积分数在不断地变小,则此阶段没有平衡前v(正) v(逆)(填“>”、“=”或“<”)。
(4)t5~t6阶段改变的条件为 ; B的起始物质的量浓度为 mol/L。
相关知识点

 C6H12O6+6O2
C6H12O6+6O2 CH3OH+H2O
CH3OH+H2O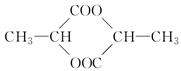 ,则X的结构简式为________________。
,则X的结构简式为________________。 有香味的产物
有香味的产物 粤公网安备 44130202000953号
粤公网安备 44130202000953号