12 g某有机物X完全燃烧后生成17.6 g CO2和7.2 g H2O。
(1)如果X是有刺激性气味的无色液体,与金属钠、碳酸钠均能反应并放出气体,则它的结构简式为____________________。
(2)如果X是易挥发有果香味的无色液体,并能水解,则它的结构简式为______。
(3)如果X的相对分子质量为90,跟醇、羧酸都能发生酯化反应,且两分子的X之间互相反应生成如下环酯: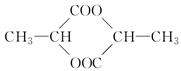 ,则X的结构简式为________________。
,则X的结构简式为________________。
12 g某有机物X完全燃烧后生成17.6 g CO2和7.2 g H2O。
(1)如果X是有刺激性气味的无色液体,与金属钠、碳酸钠均能反应并放出气体,则它的结构简式为____________________。
(2)如果X是易挥发有果香味的无色液体,并能水解,则它的结构简式为______。
(3)如果X的相对分子质量为90,跟醇、羧酸都能发生酯化反应,且两分子的X之间互相反应生成如下环酯: ,则X的结构简式为________________。
,则X的结构简式为________________。