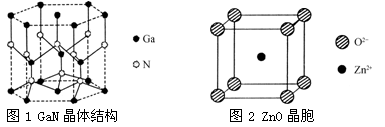
工业制硝酸经以下一系列反应: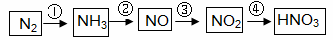
请回答:
(1)写出反应④的化学方程式 ,实验室收集NO的方法是 。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H= kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式 。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下: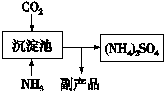
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析) 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。