聚乙烯醇Z是具有广泛用途的合成高分子材料,结构简式为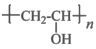 ,其工业合成路线如下:
,其工业合成路线如下: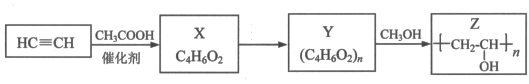
已知:下列反应中R,R',R"代表烃基
i.
ii.
回答下列问题:
(1)X的结构简式是________________________;
(2)Y转化为Z的化学方程式是________________________;
(3)已知:
在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式。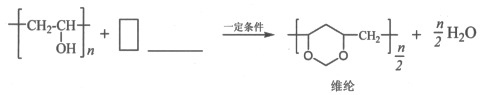
聚乙烯醇Z是具有广泛用途的合成高分子材料,结构简式为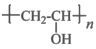 ,其工业合成路线如下:
,其工业合成路线如下:
已知:下列反应中R,R',R"代表烃基
i.
ii.
回答下列问题:
(1)X的结构简式是________________________;
(2)Y转化为Z的化学方程式是________________________;
(3)已知:
在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式。