(本题共13分)氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为:
4NH3(g) +5O2(g) 4NO(g)+6H2O(g)+Q,完成下列填空:
4NO(g)+6H2O(g)+Q,完成下列填空:
23.如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.将水液化移走
24.在500℃时,在2L密闭容器中加入10mol NH3、10mol O2,上述可逆反应达到平衡,过程如图所示,在a时刻改变反应条件,重新达到平衡,该改变的条件可能是 ,比较b时刻与c时刻反应氨的转化率大小(填“>”或“<”)b c。其它条件不变,c时刻加压后,若平衡正向移动,其原因可能是 ,若在d时刻重新达到平衡,请在图中画出c到d的相关变化图像。
25.工业上以氨和空气为原料生产硝酸,请画出硝酸工业的物质流程图。
26.氨中氮元素原子最外层电子排布的轨道表达式是 ,短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为 。其中非金属元素形成的氢化物的稳定性由强到弱为的顺序为(用化学式表示) 。
27.已知NH3与N2H4都是氮的氢化物,N2H4的电子式是 。NH3与N2H4都具有还原性,可以与其它强氧化剂反应,例如在一定条件下,氨可以被双氧水氧化为游离态氮,写出该反应的化学方程式 。
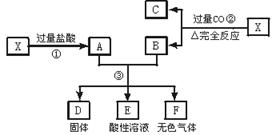
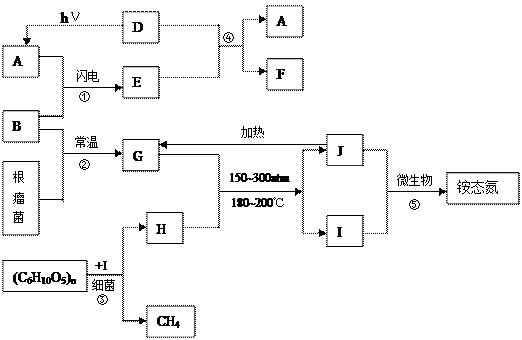
 (4) ⑤的离子方程式是,该反应的意义是什么?
(4) ⑤的离子方程式是,该反应的意义是什么?
 粤公网安备 44130202000953号
粤公网安备 44130202000953号