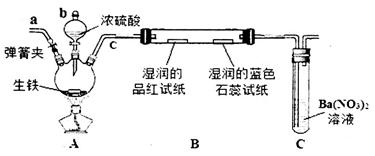
(19分)Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,实验装置如下:
Ⅰ.实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是_________________;
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经____________(填写操作名称)、过滤、洗涤、干燥,得到产品。
Ⅱ.[探究与反思]
(1)装置D的作用是检验装置C中SO2的吸收效率,则B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
(2)实验制得的Na2S2O3•5H2O样品中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
(3)为减少装置A中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是____________________。
Ⅲ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32‾+I2===S4O62‾+2I-
(1)滴定至终点时,溶液颜色的变化:___________________。
(2)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号