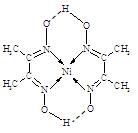
(16分)工业上利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、双氧水等为原料制备K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)的部分实验过程如下:
反应的原理如下:
沉淀:(NH4)2Fe(SO4)2·6H2O+H2C2O4 FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
氧化:6FeC2O4+3H2O2+6K2C2O4 4K3[Fe(C2O4)3]+2Fe(OH)3
4K3[Fe(C2O4)3]+2Fe(OH)3
转化:2Fe(OH)3+3H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
(1)溶解的过程中要加入几滴稀硫酸,目的是 。
(2)沉淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是 。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程中温度不宜过高的原因可能是 。
(4)为测定该晶体中铁的含量,该工厂化验室做了如下实验:
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250. 00mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根离子恰好全部氧化成二氧化碳。向反应后的溶液中加入足量锌粉,Fe3+被还原为Fe2+。然后过滤、洗涤,将滤液及洗涤液一并转入锥形瓶,此时溶液仍呈酸性。
步骤三:用标准KMnO4溶液滴定步骤二所得溶液中的Fe2+,记录消耗KMnO4溶液的体积(滴定中MnO4—被还原成Mn2+)。
步骤四: ……
步骤五:计算,得出结论。
请回答下列问题:
① 步骤一中需要用到的玻璃仪器有烧杯、量筒、玻璃棒、 、
② 步骤二中若加入KMnO4的量不足,则测得铁含量 (填“偏低”、“偏高”或“不变”);
③ 写出步骤三中发生反应的离子方程式:
④ 请补充步骤四的操作:
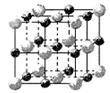
 Fe(s)+CO2(g)△H=-1kJ/mol。
Fe(s)+CO2(g)△H=-1kJ/mol。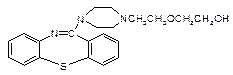 )2·
)2· ,它的合成路线如下:
,它的合成路线如下:
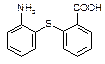 中除硫醚键(-S-)外,还含有的官能团名称为。
中除硫醚键(-S-)外,还含有的官能团名称为。 为原料合成
为原料合成 (用合成路线流程图表示,并
(用合成路线流程图表示,并 (主产物);
(主产物);
 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:。
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号