黄铜矿(主要成分CuFeS2)是提取铜的主要原料
已知:2CuFeS2+4O2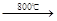 Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到 mol铜
黄铜矿(主要成分CuFeS2)是提取铜的主要原料
已知:2CuFeS2+4O2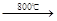 Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到 mol铜