(本题共12分)
水的电离平衡曲线如图所示。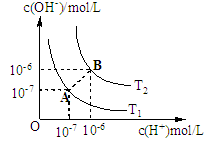
(1)若从A点变动到B点,可以采取的措施是 .
A.加酸溶液 B.加碱溶液 C.加热
(2)现有T1温度下,pH=12的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为 ; ②向该温度下100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量(假设混合溶液的体积等于混合前两溶液的体积和),此时溶液的pH 7(填“大于”、“小于”或“等于”);原混合溶液中硫酸钠的物质的量浓度为 。
(3)T2温度下,将pH=8的Ba(OH)2溶液与pH=5的稀硫酸混合,使混合后溶液的pH=7,则Ba(OH) 2溶液和稀硫酸的体积比为 。
(4)T1温度下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
②相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是: 。
③向NaClO溶液中通入少量二氧化碳,反应的离子方程式为: 。
 B
B C
C  D
D  E
E F
F
 粤公网安备 44130202000953号
粤公网安备 44130202000953号